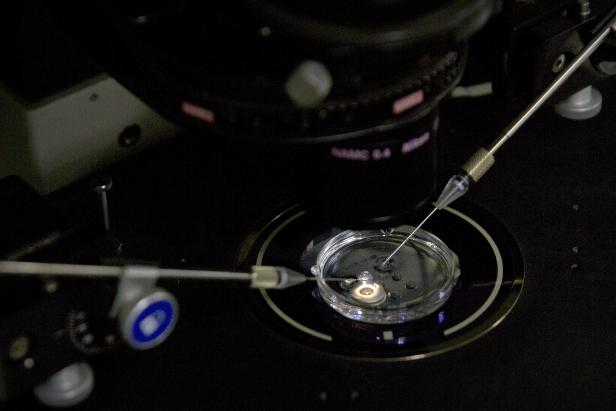
Gentechnik: Wie leben die ersten CRISPR-Kinder?
10. Juni 2017, Shenzen, China: Zwei Paare nehmen Platz an einem großen hölzernen Konferenztisch der Southern University of Science and Technology (SUSTech). Die beiden haben dasselbe Problem: Sie können nicht auf natürlichem Weg schwanger werden und wollen es mit künstlicher Befruchtung versuchen. Zu ihnen setzen sich der damals 33-jährige Biophysiker He Jiankui und ein enger Mitarbeiter; ein weiterer Kollege filmt das Gespräch mit einer Videokamera. „Wir wollen Ihnen einige ernste Dinge sagen, die Ihnen Angst machen könnten“, beginnt He und erklärt den vier potenziellen Versuchsteilnehmern zuerst die künstliche Befruchtung. Weil die beiden Väter in spe HIV-positiv sind, sollen ihre Spermien vorab behandelt werden, sodass die Kinder gesund geboren werden können.
Auf den entscheidenden Punkt kommt He erst im Laufe des 50 Minuten dauernden Treffens zu sprechen. Er führt die beiden Paare durch die Formulare einer Einverständniserklärung, deren Überschrift irreführend ist: „Das Forscherteam startet hiermit die Entwicklung einer AIDS-Impfung.“ Was He wirklich will, steht im Kleingedruckten und ist so formuliert, dass es ein Laie kaum verstehen kann, wie ein Schweizer Ethiker später feststellen wird. He Jiankui erklärt sein Anliegen immerhin mündlich.
Er will die im Reagenzglas entstandenen Embryonen manipulieren, sie den beiden ihm gegenübersitzenden Frauen einpflanzen und so die weltweit ersten gentechnisch veränderten Babys zur Welt bringen. In seinem Labor sollen HIV-resistente Menschen entstehen. Ihr genetischer Bauplan soll ihnen das Schicksal ihrer Väter ersparen. Die zukünftigen Eltern lassen sich überzeugen, und am Ende willigen sie ein.
Mehr als ein Jahr später, im Herbst 2018, verkündet He per Video auf YouTube die Geburt von zweieiigen Zwillingsmädchen. Er gibt ihnen die Decknamen Lulu und Nana. „Sie sind so gesund wie jedes andere Baby auch“, sagt He. Er habe „eine ganze Familie geheilt“, die ihre Kinder nicht dem Risiko aussetzen wollte, sich eines Tages mit HIV zu infizieren und mit diesem Stigma zu leben.
Über He Jiankui bricht ein Sturm der Entrüstung herein. Man nennt ihn einen verantwortungslosen Schurken und sogar „Chinas Frankenstein“.
Am härtesten trifft He wohl die harsche Kritik seiner Kolleginnen und Kollegen rund um den Globus. Die Nobelpreisträgerin Jennifer Doudna fiel aus allen Wolken, als sie ein E-Mail mit dem Betreff „Babies born“ von He erhielt: „Ehrlich gesagt, ich dachte, das ist ein Fake, ein Witz! Wer schreibt allen Ernstes so ein E-Mail? Es war schockierend auf eine verrückte, fast komische Art und Weise“, erinnert sich Doudna im Fachblatt „Science“. Die US-Forscherin hatte 2012 das Werkzeug erfunden, das He Jiankui verwendete: die Genschere CRISPR/Cas9.
Die Zwillinge Lulu und Nana sind heute drei Jahre alt. Ein drittes Baby, das wahrscheinlich ebenfalls ein Mädchen ist, soll im Sommer des Jahres 2019 zur Welt gekommen sein. Dessen Gene soll He in der gleichen Weise verändert haben. Der Unternehmer und Wissenschafter, der einige Zeit in den USA geforscht hat, wurde in China im Dezember 2019 zu drei Jahren Haft und einer Strafe von knapp 400.000 Euro verurteilt.
Und was ist mit den Kindern? Was weiß man heute über sie? Welche Folgen könnten die Eingriffe auf ihre Gesundheit, auf ihre Psyche und nicht zuletzt auf ihre Nachkommen haben? Um diese Fragen zu klären ist es wichtig zu wissen, wie He die Keimbahn der Embryos verändert hat. Nur: Seine Versuche, das Experiment in einer Fachzeitschrift zu veröffentlichen, scheiterten. Keines der Journale wollte die Arbeit drucken, zum einen aus ethischen Gründen, zum anderen wegen eklatanter Qualitätsmängel.
Alles, was man weiß, stammt deshalb aus Hes Videos und einem Vortrag bei einer internationalen Konferenz zum Thema Gentechnik in Hongkong, den er einen Tag nach Bekanntwerden der Zwillingsgeburt hielt. Demnach benutzte er die Genschere CRISPR, um aus der Keimbahn der Embryos den Rezeptor CCR5 zu entfernen. CCR5 bietet das Einfallstor für das HI-Virus in den menschlichen Körper. Die Krux ist freilich: Niemand weiß genau, welche Funktion der Rezeptor sonst noch hat. Wäre er ausschließlich eine Gefahr, hätte ihn die Evolution wohl bereits aus unserem Genom beseitigt. Es besteht der Verdacht, dass CCR5 auch beim Immunsystem und bei der Gehirnentwicklung eine Rolle spielt.
Ein weiteres Problem: Die Genschere CRISPR ist zwar ein sehr präzises Werkzeug, aber trotzdem noch nicht fehlerfrei einsetzbar. Eine Komplikation hat He Jiankui sogar zugegeben. Er hat bei Lulu einen sogenannten Off-Target-Effekt gefunden. Das heißt, die Genschere hat an einer Stelle geschnitten, die dem Rezeptor CCR5 sehr ähnlich sah – und hat somit ihr wahres Ziel verfehlt. Welche Gene sie dort womöglich zerstört hat, ist unklar. Eine biologische Auswirkung sei unwahrscheinlich, behauptete He. Viele Expertinnen und Experten bezweifeln allerdings, dass es bei einem einzigen Off-Target-Effekt geblieben ist. „Diese Fehler sind wie Küchenschaben: Sieht man einen, muss man mit mehreren rechnen“, sagt die Wiener Molekularbiologin Reingard Grabherr. Sie arbeitet selbst seit Jahren mit der Genschere und ist Mitglied der österreichischen Gentechnikkommission.
Vor seiner Verhaftung hatte He Jiankui die DNA der noch ungeborenen Babys aus dem Blut der Mutter und der Plazenta in eine Datenbank eingespeist. Der US-Genetiker Kiran Musunuru hat sich diese genau angesehen – und er ist beunruhigt: „Lulu und Nana haben wahrscheinlich genetische Mosaike“, sagt er gegenüber dem Fachblatt „Nature Biotechnology“. Ein solches Mosaik kann auch auf natürliche Weise entstehen, indem die Zellen eines Embryos unterschiedliche Genome entwickeln. Von Experimenten mit Affen weiß man, dass Mosaikformen nach CRISPR-Behandlungen der Keimzellen häufig auftreten.
Nun führt ein genetisches Mosaik nicht unweigerlich zu Krankheiten, es kann diese allerdings begünstigen: Manche Menschen haben marmorartige Veränderungen der Haut, andere leiden an Wachstumsstörungen, aber auch neuropsychiatrische
Erkrankungen und manche Krebsarten können möglicherweise auf diesen Defekt zurückgehen.
Wie ein anonymer Informant „Nature“ gegenüber sagte, dürften die von He Jiankui von Anfang an geplanten Untersuchungen der CRISPR-Kinder weiterhin stattfinden. Die Zwillinge haben gleich nach der Geburt, nach einem Monat, nach einem halben und nach einem ganzen Jahr viele medizinische Checks durchlaufen. Die bislang letzte Untersuchung soll zu ihrem dritten Geburtstag im Oktober stattgefunden haben. Genetiker aus aller Welt raten jedenfalls zu möglichst genauen Untersuchungen des Genoms. „Gar nicht so sehr für die Wissenschaft, sondern vor allem im Sinne der Kinder“, sagt auch Markus Hengstschläger von der MedUni Wien. Denn die genetische Diagnostik bietet so etwas wie einen Blick in die Zukunft. Die Risiken für bestimmte Erkrankungen können dadurch eventuell früh erkannt werden.
Neben gesundheitlichen Konsequenzen drohen den CRISPR-Kindern auch psychologische Folgen. Nach seinem 20-minütigen Vortrag auf der Konferenz in Hongkong wurde He Jiankui von seinen Kollegen regelrecht gegrillt. Ob er sich eine Sekunde lang Gedanken über die Psyche der Mädchen gemacht habe, fragte ihn etwa die Entwicklungsbiologin Maria Jasin. Denn bereits in der Petrischale bestand ein eklatanter Unterschied zwischen Nana und Lulu: Erstere ist widerstandsfähiger gegenüber dem HI-Virus, weil bei ihr zwei Stellen des CCR5-Gens entfernt wurden, bei Lulu nur eine. „Vielleicht wird Nana als vielversprechendere künftige Ehefrau anders erzogen als Lulu. Was sagen Sie dazu?“, fragte Maria Jasin. He erwiderte: „Darauf weiß ich keine Antwort.“
Bisher dürfte die Geheimhaltung der Identität der CRISPR-Kinder funktionieren. Doch die Angst der Eltern, irgendwann aufzufliegen, ist anonymen Quellen zufolge groß. Eine wichtige Frage wird nicht zuletzt deshalb sein: Wann sagen sie ihren Kindern, wie sie entstanden sind? Experten der US National Academies of Science und der UK Royal Society empfahlen 2020, es so zu machen wie beim Nachwuchs aus herkömmlicher künstlicher Befruchtung: Man solle die Kleinen so früh wie möglich einweihen.
Spätestens wenn die Mädchen selbst an eine Schwangerschaft denken, müssen sie sich ihrer einzigartigen Geschichte bewusst sein. Denn Hes Manipulationen werden mit großer Wahrscheinlichkeit auch die Nachfahren von Nana und Lulu betreffen. „Das ist einer der vorgebrachten Gründe, warum der Eingriff in menschliche Keimzellen in fast allen Ländern der Welt verboten ist und in der Wissenschaft aktuell noch überwiegend abgelehnt wird“, sagt Markus Hengstschläger, Genetiker und Vizevorsitzender der österreichischen Ethikkommission.
Nicht vererbbar und deshalb auch hierzulande bereits im Einsatz sind hingegen somatische Gentherapien. So wurde einem vier Monate alten Baby aus Salzburg intravenös das Gen SMN1 verabreicht, das ihm fehlte. Das Kind hatte deshalb an einer oft tödlich verlaufenden Spinalen Muskelatrophie (SMA) gelitten – und konnte durch die Gabe gerettet werden.
He Jiankuis Handeln ist auch deshalb so verwerflich, weil es medizinisch unnötig war. Man kann sich vor HIV ganz einfach schützen, indem man beim Geschlechtsverkehr ein Kondom benutzt. Und auch wenn man sich ansteckt, ist dank guter Medikamente ein langes Leben möglich.
Gibt es dennoch Erbkrankheiten, die man schon bei der Entstehung des Embryos heilen könnte – und die dadurch auch für die nächsten Generationen keine Rolle mehr spielen? Durchaus, sagt Biotechnologin Grabherr. Es gibt viele Gendefekte wie zum Beispiel die Bluterkrankheit, bei der den Betroffenen nur ein bestimmtes Gen fehlt oder nicht funktioniert. Leiden beide Eltern an der Erkrankung, lohne es sich, einen Embryo zu untersuchen und ihm das Gen per CRISPR gezielt einzusetzen. „Allerdings erst, wenn die Genschere völlig ausgereift ist“, sagt Grabherr.
Bereits in den nächsten zehn Jahren könnte es möglicherweise so weit sein, sagt Genetiker Hengstschläger. Die Technologie entwickle sich rasant weiter. Eines sei jedoch klar: Der Fokus von Keimbahntherapien wird auf monogenen Erkrankungen liegen – bei denen also ein einzelnes Gen betroffen ist.
Das „Designerbaby“ mit hohem IQ, bestimmten Talenten oder definierter Haarfarbe bleibt noch lange Science-Fiction. Der Mensch besitzt bis zu 22.000 Gene. Es ist nicht einmal ansatzweise geklärt, wie sie untereinander und mit der Umwelt in Wechselwirken stehen, um ein bestimmtes Können oder Aussehen zu erlangen. Zum Glück.