Impfungen gegen Krebs: Wie die neuen Immuntherapien funktionieren
Schriftgröße
An großen Worten fehlte es nicht: Von „bahnbrechenden Entwicklungen“ und einer „neuen Ära der Medizin“ sprachen manche Forschende. Andere zeigten sich „unglaublich begeistert“, teils war von einem „Game Changer“ die Rede. Die Zuschreibungen bezogen sich auf innovative Behandlungen gegen Krebs, die in den vergangenen Wochen vorgestellt wurden. Ende Mai gab der 55-jährige Elliot Pfebve britischen Medien bereitwillig Interviews – als erster Patient, der einen neuartigen Impfstoff mit der vorläufigen Bezeichnung „R07198457“ erhält. Die Behandlung gegen Darmkrebs erfolgt im Rahmen einer klinischen Studie, die die Wirksamkeit des Impfstoffs an knapp 230 Patientinnen und Patienten bis 2027 testen soll.
Nur wenige Wochen zuvor hatte die Öffentlichkeit von einem ähnlichen Therapieansatz erfahren, der ebenfalls in England erprobt wird: An mehreren Spitälern sollen in Summe rund 1100 Personen eine Substanz namens „mRNA-4157 (V940)“ injiziert bekommen. Auch diese Impfung soll sich gegen Krebs richten: gegen das Melanom, die bösartigste Form von Hautkrebs.
Bekannte Namen seit der Corona-Pandemie
An die Hersteller der Impfstoffe erinnern sich vermutlich viele Menschen, und zwar aufgrund der Coronaviruspandemie: Es handelt sich um das US-Pharmaunternehmen Moderna sowie das deutsche Biotech-Start-up BioNTech. Letzteres begann nun die Darmkrebs-Studie, Moderna untersucht die Wirksamkeit der neuen Substanz gegen das Melanom.
Die Entwicklungen haben nicht nur gemeinsam, dass sie auf die Bekämpfung von Krebs abzielen. Beide Unternehmen setzen außerdem auf dasselbe Werkzeug: Sie versuchen, mRNA-Impfstoffe gegen Krebserkrankungen zu lenken – folgen also genau jenem Prinzip, das gegen das Coronavirus eingesetzt wurde und für leidenschaftliche Debatten gesorgt hatte, die jedoch von sehr unterschiedlichen Emotionen geprägt waren. Während die Wissenschaftswelt meist beeindruckt von dem Tempo war, mit dem die Technologie verfügbar war und klassischen Impfungen den Rang ablief, hatten viele Menschen genau deshalb Sorgen vor womöglich unbekannten Nebeneffekten.
Immunsystem gegen Krebszellen
Was ist nun davon zu halten, dass die mRNA-Technologie zu einer neuen Waffe gegen Krebs werden soll? Wie funktionieren solche Impfungen überhaupt? Und sind die großen Hoffnungen gerechtfertigt, die im Moment in sie gesetzt werden?
mRNA-Impfungen zählen zu einer jüngeren Generation von Krebstherapien, die bezwecken, das Immunsystem in den Kampf gegen Krebs- beziehungsweise Tumorzellen zu führen. Krebsimmuntherapien stellten eine Art Paradigmenwechsel nach den traditionellen Behandlungen wie Chemo- und Strahlentherapie dar. In die Klasse der Immuntherapeutika fällt beispielsweise auch eine offenbar vielversprechende Impfung gegen Brustkrebs, die von österreichischen Forschenden soeben bei einer Konferenz in Chicago präsentiert wurde: Anhand eines relativ kleinen Kollektivs von 400 Patientinnen ließ sich zeigen, dass Sterblichkeit wie auch das Risiko für Metastasen deutlich gesenkt werden konnte – ein Ergebnis, das interessanterweise erst sieben Jahre nach Durchführung der Studie zutage trat und nun im Detail analysiert werden muss. Anfangs schien der Impfstoff eine Enttäuschung zu sein.
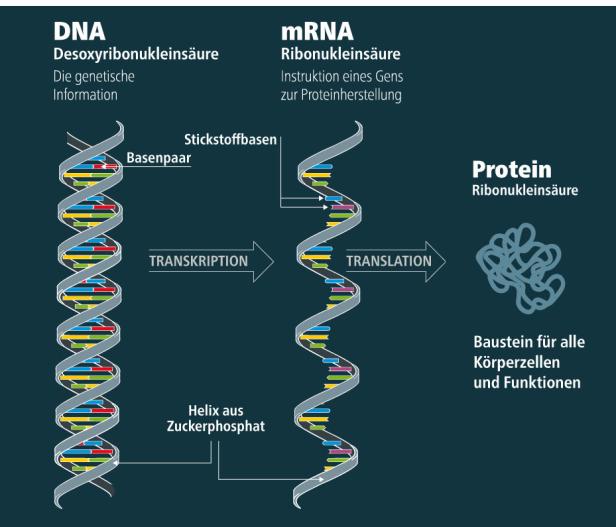
Um eine mRNA-Impfung handelt es sich dabei allerdings nicht. mRNA-Impfungen stellen eine spezielle Form einer Immunbehandlung dar. Die Medizin macht sich dabei ein Prinzip der Natur zunutze: Unser Körper braucht Boten-Ribonukleinsäure (Englisch: messenger Ribonucleic Acid, kurz mRNA), um die Bauanleitung für Proteine an die Körperzellen zu schicken, also gleichsam eine Nachricht zum Zwecke der Produktionsanleitung. Proteine sind nichts anderes als Eiweiß, und dieses ist der Baustoff allen Lebens. Ob Muskeln, Haare, Haut oder Organe – alles beruht auf Proteinen. Gleiches gilt für die Auslöser vieler Krankheiten, seien es nun Viren oder Allergene. Und wenn das Immunsystem Abwehrstoffe gegen Krankheitsauslöser abkommandiert, tut es das ebenfalls mithilfe von Proteinen.
mRNA ist nun gewissermaßen die Software zur Proteinherstellung: eine molekulare Botschaft, die den Körperzellen, die als Eiweißfabriken dienen, mitteilt, welche Proteine sie produzieren sollen. Die Wissenschaft begann sich zu fragen: Was, wenn man der Natur ihre Konstruktionsweise abschauen und für medizinische Anwendungen kopieren könnte? Was, wenn man selbst eine mRNA-Botschaft „verfassen“ und zur Herstellung gewünschter Eiweißstoffe an Körperzellen schicken könnte? Da alles Leben und sehr viele Krankheiten auf Proteinen basieren, wäre dies, so der Gedanke, der Schlüssel zu einem Universalwerkzeug der Medizin.
Ein hürdenreicher Weg
Zu den Pionieren der mRNA-Technologie zählten besonders zwei Forschende: der amerikanische Molekularbiologe Robert Malone und die in Ungarn geborene Biochemikerin Katalin Karikó, die für ihre Grundlagenarbeit auf dem Gebiet inzwischen mit einem Nobelpreis für Medizin bedacht wurde. Es war ein langer und beschwerlicher Weg, der in den 1970er-Jahren begann. Den Forschenden stellten sich zahlreiche Hürden in den Weg: mRNA ist zum Beispiel extrem instabil und zerfällt sehr rasch. Wie könnte es gelingen, die Haltbarkeit zu erhöhen? Und wie könnte man sie überhaupt in Körperzellen schleusen, um die beabsichtigten Proteine zu erzeugen?
Katalin Kariko
Die in Ungarn geborene Biochemikerin begann bereits in den 1070er-Jahren mit Forschungen an der medizinischen Anwendungen von mRNA. Die längste Zeit hielt man ihre Arbeit für nutzlos. Inzwischen erhielt Kariko einen Nobelpreis. Und die mRNA-Technologie gilt als eine der Zukunftshoffnungen der Medizin.
Die längste Zeit hielt man die Technologie für eine Sackgasse. Karikó berichtete, dass kaum jemand ihre Arbeit ernst nahm, stattdessen wurden ihr Forschungsgelder gestrichen. Doch sie gab nicht auf, verbrachte viele Nächte im Labor und forschte weiter. Mit der Zeit entstanden auch ein paar Start-ups, die mRNA-Therapien für zukunftsträchtig hielten. Darunter waren auch BioNTech im deutschen Mainz, gegründet 2008, und Moderna in den USA, gegründet zwei Jahre später. Der neue Zweig führte lange ein Schattendasein, es war eine kleine Gemeinde, die sich „mRNA-People“ nannte und sich regelmäßig zu Konferenzen traf, weitgehend unter dem Radar der Öffentlichkeit.
Dann kam die Pandemie. Und plötzlich kannte die ganze Welt das Kürzel mRNA, weil Impfstoffe dieser Klasse die ersten waren, die man gegen das Coronavirus zur Verfügung hatte.
Dabei waren die Corona-Impfungen eigentlich ein Nebenprodukt der mRNA-Forschung, ein erster Realitätstest der neuen Technologie. Das Hauptziel war aber von Anfang an die Krebsbehandlung gewesen. Wenn jetzt die ersten Krebs-Impfungen auf mRNA-Basis in greifbare Nähe rücken, schließt sich gewissermaßen der Kreis – wobei die Pandemie wohl eine Art Booster für die vormals bescheidene Branche darstellte, in der öffentlichen Wahrnehmung wie auch ökonomisch.
Eine Schutzimpfung gegen ein Virus ist, verglichen mit einer Krebsbehandlung, eine relativ leichte Übung. Denn solch ein Impfstoff ist für sämtliche Personen stets gleich. Zur Covid-Impfung benutzte man ein Oberflächenprotein des Virus, das sogenannte Spike-Protein. Dieses wurde, stark vereinfacht ausgedrückt, als mRNA-Botschaft an Körperzellen geschickt. Diese produzierten fortan selber Spike-Proteine. Damit erhielt das Immunsystem ein Profil des Erregers, konnte es sich merken und später, bei Kontakt mit einem echten Virus, flott die Körperabwehr hochfahren.
Krebs, ein sehr bewegliches Ziel
Krebs dagegen ist höchst individuell und kann sich von Person zu Person stark unterscheiden. Krebszellen verändern sich zudem unablässig: Sie mutieren ständig, sind daher bewegliche Ziele und versuchen, sich mit verschiedensten Tricks den Attacken des Immunsystems zu entziehen. Das ist einer der Gründe, warum Therapien schwierig und allzu oft erfolglos sind. Eine Krebsimpfung ist damit viel komplizierter als eine gegen ein Virus, weil man für jeden einzelnen Patienten eine maßgeschneiderte Behandlung entwickeln müsste – zugeschnitten auf seinen speziellen Krebs. Und genau das sollen die neuen Krebsimpfungen auf mRNA-Basis leisten.
Die Vorgangsweise ist bei beiden neuartigen Therapien gleich: Personen, die an den Studien teilnehmen, haben bereits eine Operation hinter sich, weshalb die Forschenden Darm- respektive Hautkrebsgewebe zur Verfügung haben – die Ausgangsbasis für das anschließende Design der individuellen Therapie. Das Krebsgewebe wird nun einer genetischen Analyse entzogen, wobei bestimmte Schlüsselstellen identifiziert werden. Im Fall des Melanom-Vakzins sind das 34 verschiedene „Neoantigene“. Dabei handelt es sich um nichts anderes als Proteine, die gleichsam als Ankerpunkte für das Immunsystem dienen: als Erkennungsmerkmale, anhand derer die Abwehr Krebszellen aufspüren und angreifen kann.
Dieser molekulare Steckbrief wird in einen mRNA-Strang umgeschrieben und verpackt und per Impfung verabreicht. Anschließend, so die Idee, produzieren die Körperzellen genau jene Eiweiße, die dem Immunsystem helfen, nach Krebszellen zu fahnden und diese zu bekämpfen. Auf diese Weise soll ein Hauptproblem der Krebsabwehr gelöst werden: In unserem Körper finden täglich Mutationen statt, die theoretisch das Potenzial hätten, Krebs zu verursachen. Doch normalerweise ist das Immunsystem sehr effizient dabei, solche Vorläufer von Krebszellen als fremd zu identifizieren und zu zerstören. Doch manchmal tarnen sich diese Zellen so geschickt, dass sie die Körperabwehr nicht erkennt – der erste Schritt zu einer Krebserkrankung.
Die Impfung soll die einzigartige genetische Signatur des konkreten Tumors eines Patienten nachbilden und den Körper anweisen, Proteine oder Antikörper herzustellen, die jene Marker attackieren, die in exakt diesen Krebszellen zu finden sind.
Ankündigung von Moderna
Dieses Versagen soll ausgeglichen werden, indem man dem Immunsystem bessere Daten liefert: den per mRNA erzeugten Bauplan für Eiweißstoffe, die für einen konkreten Tumor spezifisch sind und die dem Immunsystem wieder auf die Sprünge helfen. Die Impfung ziele laut Moderna darauf ab, „die einzigartige genetische Signatur des konkreten Tumors eines Patienten“ nachzubilden und den Körper anzuweisen, „Proteine oder Antikörper herzustellen, die jene Marker attackieren, die in exakt diesen Krebszellen zu finden sind“. Die Impfung kennzeichnet somit wie Nebellichter jene Ziele, die das Immunsystem ansteuern soll.
Ein weiter Weg bis zur Marktzulassung
Wie gut funktioniert nun diese neuartige Therapieform? Und wann darf man gegebenenfalls mit solch maßgeschneiderten Behandlungen rechnen? Kommt auf den Impfstoff an: Moderna ist bei der
Erprobung seiner Entwicklung ein Stück weiter als BioNTech. Bei den Tests des Melanom-Vakzins beginnt gerade die sogenannte Phase III, die letzte große Etappe der klinischen Prüfung vor einer möglichen Einreichung zur Marktzulassung. Das Prozedere ist dabei immer gleich: Auf Laborstudien folgen erste Tests an kleinen Patientengruppen und schließlich an immer größeren Kollektiven, bevor – sofern jeweils positive Ergebnisse vorliegen – bei den Medizinbehörden um Zulassung angesucht werden kann.
Der Impfstoff mRNA-4157 (V940) von Moderna hat mittlerweile Phase II absolviert. Die Ergebnisse wurden im Februar in der Fachzeitschrift „The Lancet“ publiziert. Über zwei Jahre waren zwei Personengruppen behandelt und beobachtet worden. 107 Personen erhielten den neuen Impfstoff und zusätzlich eine konventionelle Krebsbehandlung. Weitere 50 Personen wurden ausschließlich traditionell therapiert. Resultat: In jener Gruppe, die den Impfstoff bekam, traten deutlich weniger Todesfälle sowie Fälle von Menschen auf, bei denen der Krebs wiederkehrte. Die neuartige Therapie stellte somit eine Überlegenheit gegenüber konventioneller Behandlung unter Beweis. Daher beginnt nun die Phase III mit größeren Patientenzahlen – auf Resultate wird man vermutlich weitere zwei Jahre warten müssen.
Der Impfstoff von BioNTech gegen Darmkrebs befindet sich dagegen erst in Phase II, wobei nun die Rekrutierung der Probanden startet. Krebsgewebe von Patienten wie Elliot Pfebve wird zunächst nach Mainz geschickt, um im Labor 20 Schlüsselstellen zu identifizieren, die dann zu den Angriffsstellen für das Immunsystem zu werden. Insgesamt 229 Personen sollen in diese Etappe der Studie eingeschlossen werden, laut Studienprotokoll ist geplant, Phase II im Juli 2027 zu beenden. Sofern die Ergebnisse ermutigend sind, kann anschließend Phase III angepeilt werden, begleitet von einigen weiteren Jahren der klinischen Prüfung, denen – eventuell – ein Antrag auf Praxiseinsatz folgen kann.
Anders ausgedrückt: So vielversprechend die ersten Ergebnisse klingen, in Griffweite sind die neuen Impfungen gegen den Krebs längst nicht, weshalb sich Patientinnen und Patienten im Moment leider noch wenig Hoffnung machen dürfen, bald auf diese Weise behandelt zu werden. Außerdem ist keineswegs sicher, dass in denn kommenden Jahren nicht noch unerwartete Probleme auftreten. Was an kleineren Patientenzahlen funktioniert, muss nicht unbedingt bei einem größeren Kollektiv funktionieren; was sich anfangs bewährt, kann später plötzlich von Rückschlägen betroffen sein (und manchmal auch umgekehrt, wie die österreichische Brustkrebs-Studie zeigt); überdies wenden Krebszellen viele Strategien an, um einer Bekämpfung zu entgehen: Wenn sie sich bloß tarnen, kann die mRNA-Impfung dem Immunsystem vermutlich die Richtung weisen. Wenn sie sich aber, was auch geschieht, gleichsam verbarrikadieren und dem Zugriff der Abwehr überhaupt entziehen, kann die Impfung wahrscheinlich auch nicht viel ausrichten.
Viele weitere innovative Therapien in Sicht
Freilich: Das ist der ganz normale Weg zur Herstellung neuer Wirkstoffe, auf dem viel schiefgehen kann – oder ein Durchbruch stehen kann. Grundsätzlich ist das Versprechen eines absehbaren Paradigmenwechsels in der Medizin gewiss nicht übertrieben. Das Prinzip von mRNA-Behandlungen ist plausibel, seit Jahrzehnten erforscht, und bisherige Studien haben gute Zwischenergebnisse geliefert. Und man darf davon ausgehen, dass wir in den kommenden Jahren noch eine Vielzahl neuer Behandlungsansätze sehen werden.
Forschende in aller Welt arbeiten unter anderem auch an Therapien gegen Blasen-, Bauchspeicheldrüsen- und Lungenkrebs, zusätzlich durchlaufen mRNA-Impfstoffe gegen Influenza, Gürtelrose und Malaria verschiedene Testphasen, und auch Autoimmunerkrankungen wie Multiple Sklerose werden derart ins Visier genommen. Denn schließlich basiert all dies auf Eiweißstoffen beziehungsweise der Fehlfunktion von Proteinen – und mRNA-Therapeutika haben mittel- und langfristig tatsächlich das Potenzial, zu einem Universalwerkzeug einer neuen Medizin zu werden.

Alwin Schönberger
Ressortleitung Wissenschaft