Spitzenforschung in Wien: Im Labor der Organzüchter
Schriftgröße
Zuletzt ging es Schlag auf Schlag: erst Epilepsie, dann Autismus, wenig später Parkinson. Der Reihe nach veröffentlichten die Forschenden in jüngster Zeit Fachartikel zu großen Fragen der Medizin, die in renommierten Journalen wie „Nature“ und „Science“ erschienen. Sie beschrieben darin Resultate der Arbeit einer Wissenschaftergruppe um Jürgen Knoblich. Der 60-jährige Molekularbiologe leitet ein Forschungsteam, das den Auslösern schwerer und oft noch rätselhafter Krankheiten auf die Spur kommen will.
Knoblichs Wirkungsstätte ist das Institut für Molekulare Biotechnologie (IMBA) der Österreichischen Akademie der Wissenschaften. Das IMBA im 3. Bezirk in Wien ist ein europäisches Zentrum der Molekularbiologie. 13 Forschungsgruppen verfolgen das Ziel, bis ins Detail Prozesse zu studieren, die in unseren Körperzellen ablaufen – und Grundlage zahlreicher gravierender Krankheiten sind. Die Forschenden kommen aus aller Welt, am IMBA wird meist Englisch gesprochen, internationale Kapazitäten überlegen sich gemeinsam mit jungen Talenten neue Forschungsfragen. Das Gebäude bietet viel offenen Raum mit Sitzgelegenheiten, die zum Gedankenaustausch einladen. Es ist ein Umfeld, das dazu beiträgt, neue Ideen hervorzubringen und zu befeuern.
Jürgen Knoblich
Der Wiener Molekularbiologe ist ein internationaler Pionier auf dem Gebiet der Herstellung von Gehirnorganoiden. Gemeinsam mit seinem Forschungsteam sucht Knoblich nach den Auslösern schwerer neurologischer Erkrankungen wie Epilepsie, Parkinson und Autismus. Das langfristige Ziel ist die Entwicklung neuartiger Therapien.
In der Wissenschaft seien Kreativität und Neugier entscheidend, sagt Knoblich, wissenschaftlicher Direktor des IMBA. In mancher Hinsicht seien Forschende wie kleine Kinder, die ihr Spielzeug zerlegen, um zu verstehen, wie es funktioniert, so der gebürtige Deutsche, der zuvor in Tübingen, London und San Francisco forschte und von Papst Franziskus in die päpstliche Akademie der Wissenschaften berufen wurde.
Knoblichs Spezialgebiet ist die Züchtung von Organoiden: von Zellstrukturen, die im Labor wachsen und realitätsnahe Modelle menschlicher Organe im Miniaturmaßstab darstellen. Mit solchen Abbildern von Organen befasst sich die internationale Forschung schon seit geraumer Zeit, und mittlerweile wurden Organoide erzeugt, die Darm, Haut, Leber und Niere repräsentieren.
Knoblichs Interesse gilt zerebralen Organoiden: Organmodellen des menschlichen Gehirns. Vor zehn Jahren sorgten er und seine damalige Post-Doktorandin Madeline Lancaster für eine Sensation, als sie eine neue Methode zur Züchtung von Hirnorganoiden präsentierten und weltweit die Ersten waren, die damit eine Erkrankung nachbildeten. Heute benutzen Institute in aller Welt das Verfahren, das 2013 unter die zehn wichtigsten wissenschaftlichen Entdeckungen des Jahres gereiht wurde.
Gehirnwachstum im Labor
Was darf man sich unter einem Gehirnorganoid vorstellen? Manchmal ist von „Mini-Gehirnen“ die Rede, doch diesen Begriff mag Knoblich gar nicht. Denn er erwecke den Eindruck, es handle sich um ein zwar verkleinertes, sonst aber komplettes Gehirn, das Eigenschaften wie Bewusstsein oder Schmerzempfindung entwickeln könnte. Das ist aber nicht der Fall: Es stellt eher einen isolierten Ausschnitt aus einem Gehirn dar, eine Portion Nervengewebe in einer Petrischale.
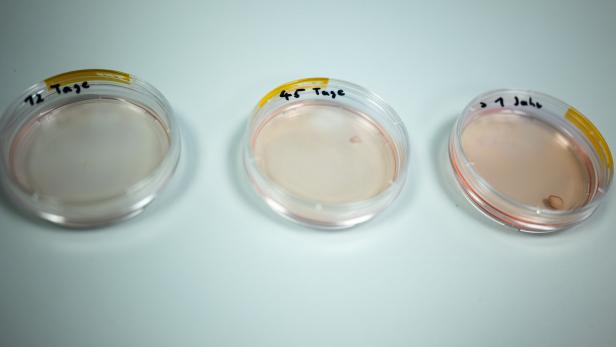
Gehirnorganoide im Labor
In solchen Behältern wachsen am Wiener Institut für Molekulare Biotechnologie Gehirnorganoide heran. Das Bild zeigt Organoide in unterschiedlichen Stadien der Entwicklung. Die Organoide werden maximal fünf Millimeter groß und sehen dann aus wie kleine, blassrosa Bällchen.
In den IMBA-Labors gedeihen Tausende Gehirnorganoide in transparenten, rund zehn Zentimeter großen Plastikbehältern. Es sind blassrosa Bällchen, die in einem Nährmedium schwimmen, das von „Shakern“, in steter Bewegung befindlichen kleinen Plattformen, durchmischt wird. Die Organoide enthalten Millionen Nervenzellen, wachsen aber nur bis zu einer Größe von maximal einem halben Zentimeter – dann stoppt das Wachstum, unter anderem deshalb, weil die Organoide über keine Blutversorgung verfügen.
In ihrem Inneren laufen dennoch dieselben Prozesse ab wie im menschlichen Gehirn: Man kann unter dem Mikroskop zusehen, wie über Tage und Wochen mehr und mehr Nervenzellen sprießen, wachsen und sich verzweigen, wie sie Synapsen – Verbindungen zu anderen Neuronen – ausprägen und miteinander kommunizieren: Die Bilder zeigen ein ständiges Blitzen und Funkeln an verschiedenen Stellen, ein Indikator für elektrische Aktivität und das typische „Feuern“ der Nervenzellen. Die Organoide rekapitulieren damit in komprimierter Form jene Abläufe, die auch in unserem Gehirn stattfinden.
Knoblich und sein Team befassen sich mit Grundlagenforschung, die aber sehr konkrete Ziele für die Medizin verfolgt. „Unser Gehirn hat einen unglaublichen Grad an Komplexität erreicht“, sagt Knoblich. „Doch diese Komplexität hat ihren Preis: eine hohe Empfindlichkeit für neurologische Erkrankungen.“ Viele dieser Krankheiten sind allerdings noch immer schlecht verstanden, es fehlt daher auch an wirksamen Therapien, die die Leiden an der Wurzel packen.
Von Menschen und Mäusen
Traditionell sind Tierversuche Basis für die Entwicklung neuer Medikamente, meist an Mäusen oder Ratten. Doch Tierversuche haben erhebliche Nachteile: Sie sind nicht nur ethisch umstritten, sie sind oft auch nur eingeschränkt aussagekräftig: Eine Maus ist eben kein Mensch, weshalb sich Ergebnisse aus Studien mit Nagetieren nur bedingt übertragen lassen. Besonders groß sind die Abweichungen beim Gehirn, wo schon die Anatomie unterschiedlich ist: Das Maushirn ist glatt, jenes des Menschen vielfach gefaltet, damit es mit seinen rund 1,4 Kilo Gewicht und fast 90 Milliarden Nervenzellen in den Schädel passt. „Unser Gehirn ist nicht einfach ein aufgeblasenes Mausgehirn.“
Auch manche Krankheiten verlaufen grundlegend anders. Dies konnten die Forschenden am IMBA am Beispiel der Tuberösen Sklerose (TSC) zeigen, einer schweren Form der Epilepsie. An ihren Organoiden fanden sie heraus, dass ein bestimmter Zelltyp Schuld an der Krankheit trägt: die übermäßige Vermehrung sogenannter CLIP-Zellen im Gehirn. Mäuse besitzen diese Zellen nicht, Tierversuche hätten die Wissenschaft daher wohl nie auf die richtige Spur gebracht.
An Gehirnorganoiden hingegen lassen sich jene Mechanismen der Krankheitsentstehung studieren, die auch in einem echten menschlichen Gehirn ablaufen. Mehr noch: Forschende können das Krankheitsbild eines konkreten Patienten untersuchen, indem sie ein Organoid aus seinen Körperzellen erzeugen. Genau das geschah bei den Forschungen über die Tuberöse Sklerose: Das Wiener Wissenschafterteam züchtete dafür Hirnorganoide aus Zellen von TSC-Patienten und hatte damit ein Modell zur Verfügung, das exakt deren je individuelles Krankheitsgeschehen nachbildete.
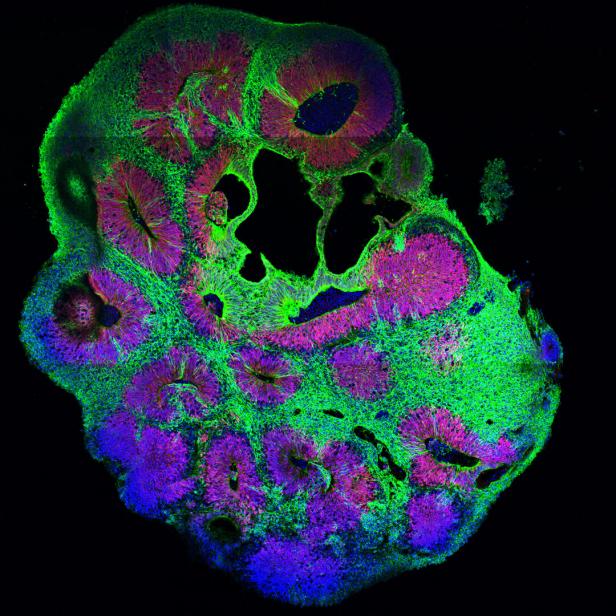
Blick in ein Gehirnorganoid
Diese mikroskopische Aufnahme zeigt das Innere eines Hirnorganoids. Darin laufen dieselben Prozesse ab wie in einem menschlichen Gehirn. Die grünen Bereiche zeigen Nervenzellen. Die Neuronen entwickeln elektrische Aktivität und feuern genau wie humane Nervenzellen.
Die Züchtung von Organoiden beginnt stets mit menschlichen Körperzellen. Die IMBA-Forschenden benutzen Haut- oder Blutzellen, die sie zunächst molekularbiologisch ins Stadium sogenannter pluripotenter Stammzellen zurückführen, eine Art Urzustand. Aus diesen jungen Zellen können anschließend verschiedenste Formen von Körpergewebe entstehen, auch Gehirn. Dazu bedarf es eines Nährmediums, einiger Wachstumsfaktoren und Eiweißstoffe sowie eines Bioreaktors – und der Rest geschieht fast von selbst. Dann kann man zusehen, wie die Nervenzellen wachsen und sich vernetzen, vom Ausmaß eines winzigen Punkts bis zu fünf Millimeter großen Objekten. Selbstorganisation nennt man diesen Prozess, bei dem die Organoide exakt die Entwicklung des menschlichen Gehirns nachahmen.
Ein Modell für Parkinson
Mithilfe solcher Organoide heftete sich die Wiener Wissenschaftergruppe kürzlich auf die Spur des Nervenleidens Parkinson. Anfang Dezember beschrieb sie in einem Fachartikel, wie sie jene drei Hirnareale nachbildete, die für die Entstehung von Parkinson entscheidend sind: das Striatum, das ventrale Mittelhirn und der Kortex. Die Forschenden züchteten die Regionen zunächst separat und ließen sie im Labor fusionieren. Es wuchs eine Gehirnregion heran, in der sogenannte dopaminerge Neuronen eine wichtige Rolle spielen. Der Name ist abgeleitet vom Botenstoff Dopamin, der unser Belohnungssystem reguliert, aber auch die Feinmotorik steuert. Ein Verlust von Nervenzellen, die Dopamin freisetzen, führt zu typischen Parkinsonsymptomen wie Zittern. Das menschliche Gehirn besitzt deutlich mehr Dopamin-Neuronen als jenes von Nagetieren, und sie sind anders verdrahtet. Auch diese Forschungen hätte man daher nicht im Tiermodell durchführen können.
Die Organoide dagegen bieten ein lebensnahes Modell des Dopamin-Schaltkreises im humanen Gehirn, eine Plattform, an der sich die Krankheitsentstehung untersuchen und künftig mögliche Therapien testen lassen. Zu diesem Zweck müsste man die Organoide mit potenziell wirksamen Substanzen in Kontakt bringen oder zerstörtes Zellmaterial ersetzen und testen, wie diese Eingriffe das Nervengewebe beeinflussen – und ob der fatale Prozess womöglich gestoppt werden kann.
Auch für eine weitere Funktion der dopaminergen Nervenzellen interessierten sich die Wiener Forschenden: deren Rolle bei der Aktivierung des Belohnungssystems. Dopamin wird ausgeschüttet, wenn wir ein Erfolgserlebnis haben oder ausgiebig Sport getrieben haben, leider aber auch nach dem Konsum von Drogen. Der Dopamin-Schaltkreis ist deshalb entscheidend bei der Suchtentstehung. Jürgen Knob-lich und sein Team prüften an Organoiden, was geschieht, wenn Nervenzellen regelmäßig mit Kokain in Kontakt geraten (Wissenschafter dürfen für spezielle Forschungen Kokain beziehen, wobei freilich jedes Brösel präzise dokumentiert sein muss).
80 Tage lang setzten sie ihre Organoide Kokain aus und konnten beobachten, wie sich Gestalt und Funktion des Dopaminsystems veränderten – diese Veränderungen blieben auch nach dem Absetzen der Kokainzufuhr erhalten, woraus sich ableiten ließ: Die Organoide waren auf Entzug. Die Forschenden konnten damit unmittelbar nachvollziehen, wie sich Sucht im Gehirn festschreibt.
Autismus-Genen auf der Spur
Nur kurz vor dieser Arbeit, im September des Vorjahres, publizierte die Gruppe einen Fachartikel über eine ebenfalls bedeutende neurologische Erkrankung: über Autismus, wobei es, so Knoblich, um gravierende Formen ging. Viele Fragen zur Entstehung von Autismus sind noch ungeklärt, doch bekannt ist, dass mehrere Gene eine Rolle spielen – darunter ausgerechnet solche, die auch für die Entwicklung der Großhirnrinde bedeutsam sind.
Die Wissenschafterinnen und Wissenschafter untersuchten an Hirnorganoiden 36 dieser Gene. Sie wählten in Kooperation mit Forschenden der ETH Zürich einen besonderen Ansatz: Sie erzeugten in jeder Zelle eines Organoids nur eine einzelne Mutation eines bestimmten Autismus-Gens. So konnten sie Zelle für Zelle und Mutation für Mutation die Auswirkungen der krankhaften genetischen Veränderungen studieren – und beobachten, wie welche Mutation zur Entstehung von Autismus beiträgt. Sie identifizierten schließlich einige Zelltypen und Netzwerkknoten im Gehirn, die besonders anfällig für die neurologische Erkrankung sind, und gelangten außerdem zur These, dass die Weichen für die Entstehung von Autismus schon in einer frühen Phase der Gehirnentwicklung gestellt werden.
Wie bei den Parkinson-Forschungen gilt auch hier: Das Verständnis der molekularen Mechanismen auf der Ebene einzelner Hirnzellen könnte der erste Schritt zur Erprobung neuer Therapeutika sein. Dass man derartige Forschungen überhaupt durchführen kann, ist auch der immer leichteren Verfügbarkeit neuer Technologien zu verdanken: Die Dechiffrierung kompletter DNA-Sequenzen ist inzwischen innerhalb eines Tages und um kaum 1000 Euro möglich. Die Genschere CRISPR/Cas9 erlaubt es, präzise Mutationen an einzelnen Genen durchzuführen – auch sie wurde am Vienna BioCenter mitentwickelt, dem Campus, auf dem sich auch das IMBA befindet. Die Mikrobiologin Emmanuelle Charpentier, mittlerweile Nobelpreisträgerin, forschte hier an den Grundlagen. „Wir können im Genom heute schreiben wie im Word-Programm“, sagt Knoblich. Und schließlich helfen künstliche Intelligenz und Machine Learning dabei, all die Daten, die bei den Organoid-Studien generiert werden, auszuwerten und zu analysieren.
Wie ein Herz zu schlagen beginnt
Sasha Mendjan deutet auf das Mikroskop auf seinem Labortisch. Der Biologe, seinerseits Gruppenleiter am IMBA, lädt ein, einen Blick durch das Okular zu werfen. Die Vergrößerung zeigt ein dunkles, ovales Objekt. Es zieht sich ein wenig zusammen und dehnt sich wieder aus. Das Objekt pulsiert in regelmäßigem Rhythmus. Mendjan demonstriert die jüngste Entwicklung seiner Gruppe: ein Kardioid, ein Organoid des Herzens. Ende November stellten die Forschenden das erste aus mehreren Kammern bestehende Herzorganoid vor. Es besitzt alle Teile eines echten Herzens: linke und rechte Kammer, Vorhof, Zu- und Abfluss des Blutes.
Sasha Mendjan
Der Biologe stellte gemeinsam mit seiner Areitsgruppe das erste Herzorganoid mit mehreren Kammern vor. Die Forschenden können zusehen, wie das Organoid zu schlagen beginnt, genau wie ein menschliches Herz während der Embryonalentwicklung.
Das Team züchtete diese einzelnen Strukturen – ebenfalls aus Stammzellen in einem Nährmedium – und beobachtete, was geschah, wenn sie gemeinsam wuchsen. Die Forschenden konnten zusehen, wie ein elektrisches Signal vom Vorhof in die linke und dann in die rechte Herzkammer wanderte. Sie wurden Zeugen, wie das Organoid zu schlagen begann, genau wie ein menschliches Herz zu Beginn der Embryonalentwicklung. Und sie bemerkten, wie perfekt die einzelnen Kammern synchronisiert waren – und auch sein müssen, damit der Mensch lebensfähig ist. „Würden zwei Kammern zugleich schlagen, wäre man fast augenblicklich tot“, sagt Mendjan.
Einen halben Millimeter messen die Kardioide zu Beginn, maximal drei bis vier Millimeter Größe erreichen sie, was ungefähr einem 35 Tage alten Embryo entspricht. „Wir wollten, dass sich die Organoide genau so entwickeln, wie es in der Natur geschieht“, berichtet Mendjan. „Dann ist es wahrscheinlich, dass nicht nur die natürliche Entwicklung nachgebildet wird, sondern auch der Prozess der Krankheitsentstehung. Schließlich gibt es fast keine Krankheit ohne entwicklungsbiologischen Hintergrund.“
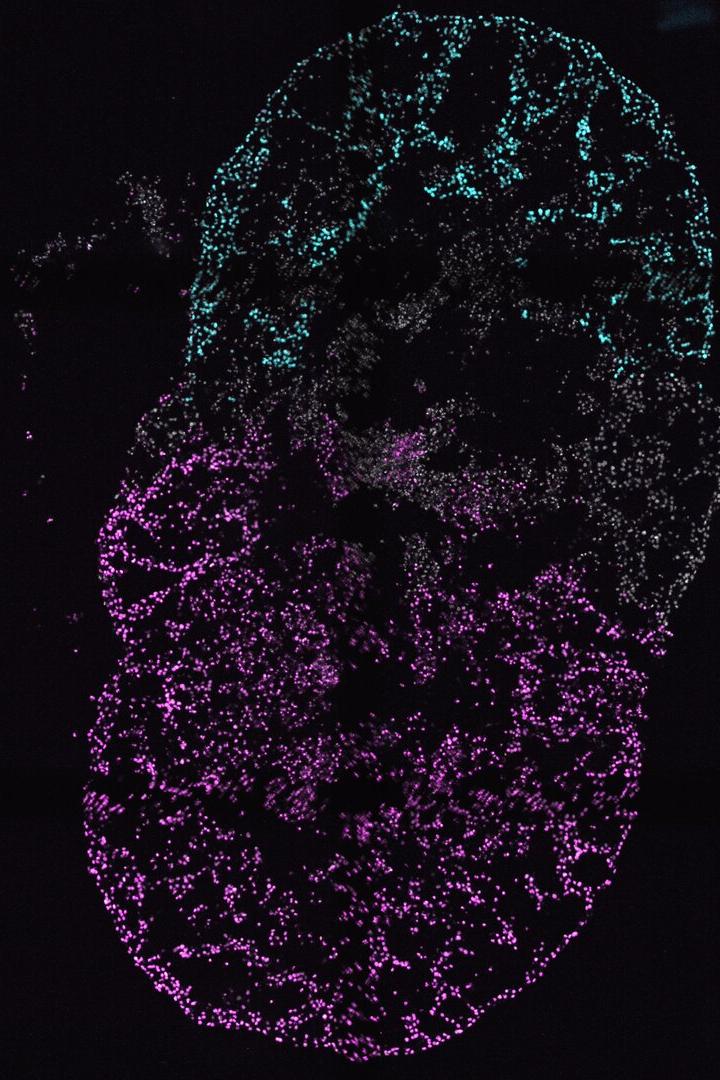
Blick in ein Herzorganoid
Das Bild zeigt eines der von Sasha Mendjan entwickelten Herzorganoide, auch Kardioide genannt. Die Kammern sind farblich markiert. Die Forschenden hoffen, mithilfe dieser Modelle ein neues Verständnis über Krankheiten zu gewinnen, deren Weichen schon sehr früh in der Enbryonalentwicklung gestellt werden.
Neues Wissen darüber wäre von unschätzbarem Wert: Herzleiden sind für die meisten Todesfälle weltweit verantwortlich. Zumindest zwei Prozent aller Kinder kommen mit einem angeborenen Herzdefekt zur Welt – vermutlich jedoch mehr, weil nicht alle Defekte erkannt werden. „Besonders die sehr frühe Phase der Herzentwicklung konnte man bisher nicht untersuchen. Doch die Weichen für viele angeborene Herzerkrankungen werden gestellt, bevor Frauen überhaupt wissen, dass sie schwanger sind.“
Wirkstoffsuche mit Organoiden
Mithilfe der Kardioide besteht erstmals die Möglichkeit, die frühen, grundlegenden Stadien der Embryonalentwicklung zu modellieren – und jene kritischen Schaltstellen zu identifizieren, die für die Entstehung genetischer Krankheiten entscheidend sind. Ein Mausherz wäre auch in diesem Fall ungeeignet: Beispielsweise schlägt ein solches 600 Mal pro Minute, zehnfach häufiger als jenes des Menschen.
Im nächsten Schritt planen die Forschenden, an ihren Organoiden neue Wirkstoffe zu testen. Da sie die humane Entwicklung nahezu wirklichkeitsgetreu abbilden, besteht die Hoffnung, dass sich daran auch der Nutzen möglicher Therapien lebensnah prüfen lässt – bis zu konkreten Effekten auf einzelne Zellen. „Unsere Vision ist es, eines Tages bereits bei Kindern kritische Mutationen zu erkennen und zu behandeln, noch bevor die Krankheit ausbricht“, sagt IMBA-Direktor Knoblich.
Es wäre ein fundamentaler Wechsel der Herangehensweise: Derzeitige Medikamente zielen zumeist darauf ab, Symptome zu bekämpfen, die Forschung an Organoiden dagegen will auf Basis eines Verständnisses der Ursachen die genetischen Auslöser beheben. Im Labor ist dies bereits gelungen, um einer Hirnerkrankung namens Mikrozephalie entgegenzuwirken. Ein Gendefekt schädigt dabei die Gehirnentwicklung, was zu einer verringerten Hirngröße führt.
Die Forschenden um Knoblich entnahmen zunächst Patienten Zellen und züchteten aus daraus hergestellten Stammzellen Organoide, die deutlich kleiner waren als sonstige Hirnorganoide und somit das tatsächliche Krankheitsgeschehen individueller Patienten spiegelten. Dann behoben sie den Gendefekt – und konnten zusehen, wie nun gesunde Organoide heranwuchsen.
Sie hatten eine grausame Krankheit schlichtweg abgeschaltet.

Alwin Schönberger
Ressortleitung Wissenschaft